Produktinformation
Das ESR1-Referenzset dient als Qualitätskontrollmaterial für ESR1-Mutationstests auf der Grundlage zellfreier DNA (cfDNA). Die Auswahl der Mutationen wurde von verschiedenen Experten auf dem Gebiet und ESR1-Testentwicklern geprüft und befürwortet.
Dieses Produkt ist ideal für PCR- und/oder Next Generation Sequencing (NGS)-Assays geeignet.
Dieses Produkt enthält den folgenden Satz separater Röhrchen:

Qualitätskontrollmaterialien (QCMs) von SensID spielen eine zentrale Rolle in klinischen Labors, die eine Vielzahl von Assays verwenden, einschließlich laborentwickelter Tests (engl. = lab developed tests; LDTs) und CE-IVD (Conformité Européenne – In Vitro Diagnostics) gekennzeichneter Assays.
Verwendung als vollständiges Workflow-Kontrollmaterial:
Für vollständige Workflow-Kontrollen empfehlen wir die Verwendung unserer humanen DNA-freien Plasmaprodukte. Mischen Sie die DNA nach Bedarf mit dem DNA-freien Plasma, um Plasmamaterialien mit den erforderlichen DNA-Konzentrationen zu erhalten.
Link zu den DNA freien Plasmaprodukten
Verwendung bei niedrigeren Allelfrequenzen-Häufigkeiten:
Wenn Sie Ihre unteren Nachweisgrenzen testen möchten, empfehlen wir die Verwendung des Wildtyp-Kontrollmaterials, welches mit dem Set geliefert wird.
OEM Optionen:
Wenn Sie Materialien als in-Kit-Kontrollen oder als Drittkontrollen für die Validierung Ihrer Kits in Kundenlabors benötigen, kontaktieren Sie uns bitte unter: sales@sens-id.com
Zur Verwendung mit LDTs für:
- Bewertung der Testgenauigkeit
- Verifizierung der analytischen Sensitivität und Spezifität
- Überwachung der Reproduzierbarkeit
- Validierung neuer Chargen und Reagenzien
- zur Gewährleistung der Qualitätssicherung
- Fehleranalyse und Fehlersuche
- Bei der Entwicklung und Durchführung von LDTs zur Identifizierung therapeutisch relevanter Mutationen in der DNA ist der Einsatz von QCMs besonders wichtig, um die Zuverlässigkeit der Ergebnisse und die Sicherheit der Patienten zu gewährleisten.
Zur Verwendung mit CE-IVD-gekennzeichneten Assays:
CE-IVD (Conformité Européenne – In Vitro Diagnostics) gekennzeichnete Assays sind kommerziell hergestellte In-vitro-Diagnostik-Assays, die die europäische Konformitätszertifizierung erhalten haben. Die Verwendung eines externen Qualitätskontrollmaterials wie das von SensID neben CE-IVD gekennzeichneten Assays in einem Labor bietet mehrere Vorteile:
- Unabhängige Bewertung: Externe QCMs werden unabhängig vom vom Hersteller des CE-IVD-Tests hergestellt. Diese Unabhängigkeit gewährleistet, dass die QCMs unvoreingenommen sind und nicht vom Assay-Hersteller beeinflusst werden, was eine objektivere Bewertung der Leistung des Labors ermöglicht.
- Validierung von Herstellerangaben: Externe QCMs können verwendet werden, um die Angaben des Herstellers zu den Leistungsmerkmalen des Assays, wie Genauigkeit, Präzision, Empfindlichkeit und Spezifität, unabhängig zu überprüfen.
- Kontinuierliche Verbesserung: Externe QCMs bieten den Labors ein Instrument zur kontinuierlichen Überwachung und Verbesserung ihrer Assay-Prozesse. Wenn bei der Verwendung externer QCMs Diskrepanzen oder Probleme festgestellt werden, können die Labors Korrekturmaßnahmen ergreifen, um die jeweilige Assay-Leistung zu überprüfen und zu verbessern.
- Einhaltung gesetzlicher Vorschriften: In einigen Regionen empfehlen oder fordern die Aufsichtsbehörden die Verwendung externer QCMs als Teil des Qualitätskontrollprozesses. Die Befolgung solcher Empfehlungen oder Anforderungen stellt sicher, dass das Labor die regionalen Qualitäts- und Akkreditierungsstandards einhält.
- Risikominderung: Durch die Verwendung externer QCMs verringern die Labore das Risiko, sich ausschließlich auf die vom Hersteller bereitgestellten QCMs zu verlassen, die möglicherweise nicht alle potenziellen Variabilitätsquellen abdecken oder die Leistung des Assays über den gesamten Analysebereich hinweg nicht angemessen überprüfen. Ein Beispiel: Bei den üblicherweise in Kits verwendeten Kontrollen werden häufig Plasmide als Positiv- und Negativkontrollen verwendet. Plasmide spiegeln nicht die Komplexität einer Patientenprobe einschließlich des gesamten genomischen Hintergrunds wider. Fragen Sie im Zweifelsfall Ihren Assay-Anbieter nach den mitgelieferten Kontrollmaterialien.
- Vertrauen in die Ergebnisse: Die Verwendung von externen QCMs trägt zum allgemeinen Vertrauen in die Genauigkeit und Zuverlässigkeit der mit CE-IVD-Assays erzielten Testergebnisse bei. Dieses Vertrauen ist von entscheidender Bedeutung, wenn diese Tests für Diagnose- und Behandlungsentscheidungen von Patienten verwendet werden.
Assay-Hersteller, die unser Material getestet haben:
Verschiedene Hersteller empfehlen die Verwendung des ESR1-Referenzsets von SensID als Qualitätskontrollmaterial. Zu diesen Assays gehört:
Zusätzliche Informationen:
Nach den Ergebnissen der randomisierten Phase-III-Studie EMERALD verlängerte sich das progressionsfreie Überleben (engl. = progression free survival; PFS) bei allen Patienten (Hazard Ratio = 0,70; 95% CI, 0,55 bis 0,88; P = .002) und bei Patienten mit ESR1-Mutation (Hazard Ratio = 0,55; 95% CI, 0,39 bis 0,77; P = .0005). Elacestrant ist der erste orale selektive ER-Degradierer, der in einer Phase-III-Studie bei Patientinnen mit ER-positivem/HER2-negativem fortgeschrittenem Brustkrebs eine signifikante Verbesserung des PFS gegenüber der Standardtherapie (engl. = standard of care; SOC) sowohl in der Gesamtpopulation als auch bei Patientinnen mit ESR1-Mutationen bei kontrollierbarer Sicherheit zeigte (2).
Puffer:
Tris-EDTA (10 mM Tris, 1 mM EDTA), pH 8,0
Lagerung:
2-8 °C
Haltbarkeit:
stabil bis 24 Monate nach Herstellungsdatum (wie geliefert)
Qualitätssicherung
Fragmentgrößenbestimmung:
Elektrophorese-TapeStation (Agilent)
Allelfrequenz/Kopienzahl:
dPCR (metrologisch anerkannte primäre Referenz Messmethode) (3)
Quantifizierung (metrologisch rückverfolgbar):
- UV-Vis Spektrophotometrie (NIST-Referenzmethode) zur Messung der gesamt DNA
- fluorometrische dsDNA Messung (Qubit)
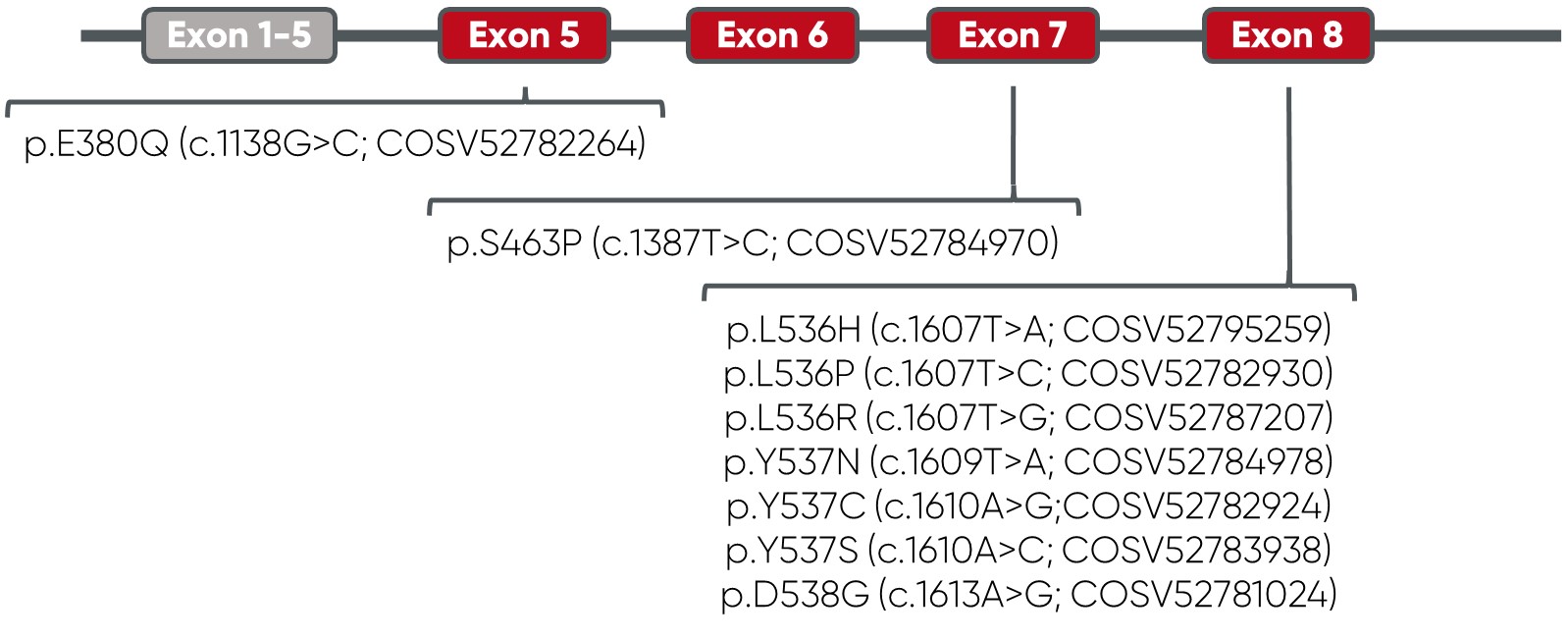
Technischer Hintergrund
Wildtyp cfDNA für die genannten ESR1 Mutationen
*GRCh38
Literatur:
- Clinical Implications of Monitoring ESR1 Mutations by Circulating Tumor DNA in Estrogen Receptor Positive Metastatic Breast Cancer: A Pilot Study
- Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial
- Assessment of Digital PCR as a Primary Reference Measurement Procedure to Support Advances in Precision Medicine